
我们知道,晚期肝细胞癌(以下简称肝癌)的治疗,已从系统化疗逐渐过渡到靶向治疗、免疫治疗以及联合治疗。虽然可选的治疗方式变多了a股加杠杆,但由于肝癌具有较高的异质性,尤其是不同病因、不同亚型患者对治疗反应存在很大差异,这就为晚期肝癌的精准治疗带来了不小的挑战。
因此,开发出可以复现人类肝癌不同分子特征的小鼠模型,并筛选出相应的药物治疗方案,对肝癌的临床研究和精准治疗意义重大。
近期,英国癌症研究所Miryam Müller和Thomas G.Bird团队发表了一项重要研究成果。他们构建了多种由人类肝癌遗传因素驱动的免疫功能完整的肝癌小鼠模型。这些模型能够模拟人类肝癌的不同分子病理特征,包括克隆起源、组织病理学特征和转移模式。
随后通过将这些小鼠模型的转录组数据与人类肝癌转录组数据进行对比,研究人员识别出了四个常见的人-鼠共通肝癌亚型(HuMo1-4型),并最终通过药物筛选发现了一种治疗毛细胞白血病的药物,克拉屈滨,可在特定小鼠肝癌亚型(尤其是HuMo1型)中表现出强效抗肿瘤作用。
研究发表在《自然》上。

论文首页截图
为了构建人类肝癌相关小鼠模型,研究人员先生成了一系列小鼠模型,并在成年小鼠肝细胞中引入类肝癌遗传驱动因子,然后再通过静脉注射载有Cre重组酶的病毒载体,将重组酶引入小鼠肝细胞,实现特定基因的重组。
最终通过对多个肿瘤驱动基因和肿瘤抑制基因进行组合,研究人员成功构建了27种免疫功能完整的,且具有不同遗传特征的自发性肝癌小鼠模型。这些模型不仅再现了人类肝癌的不同分子病理特征,包括克隆起源、组织病理学特征和转移模式(主要是肺转移),还揭示了基因组合对肿瘤生长的不同影响(肿瘤的大小以及生存期均与突变的数量和类型密切相关)。
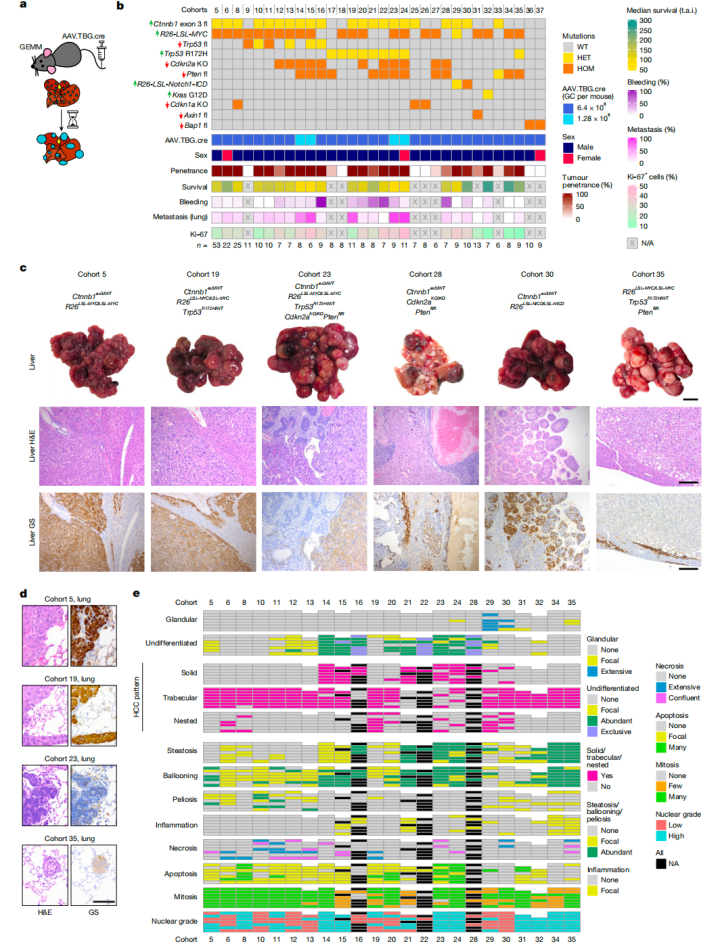
小鼠模型建立
随后为了观察这些肝癌小鼠模型能否代表人类肝癌类型,研究人员将这些小鼠模型的转录组数据与人类肝癌转录组数据进行对比,并识别出了四个常见的人-鼠共通肝癌亚型(HuMo1-4型)。
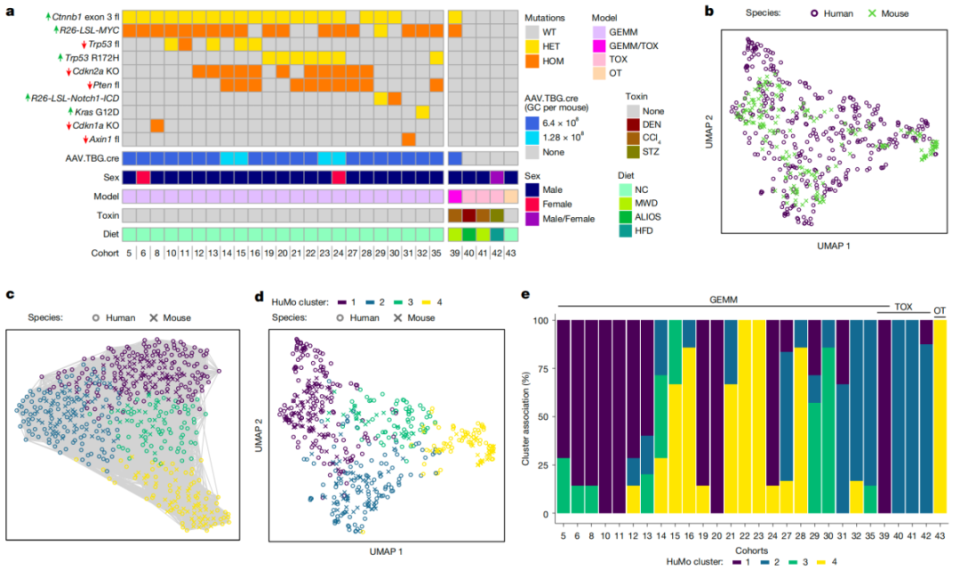
四个共享肿瘤亚型
这四个亚型在基因表达、免疫反应、组织学表现等方面都有所不同,其中HuMo1型,主要富集了一些与代谢和分化相关的通路,且具有明显免疫排斥特征,对免疫检查点抑制剂(ICI)反应较差。HuMo2型,主要富集了炎症相关信号通路,具有明显的免疫活跃特征。HuMo3和4型均为低分化且增殖性强的类型,其中HuMo4型还表现出了上皮-间质转化的特征。
接下来,研究人员想知道这四个亚型对标准治疗的反应。通过对比分析TCGA数据集,研究人员发现,HuMo1型对标准治疗的反应,对应了人类临床研究中一种常见且难治的肝癌亚型(表现为大多存在CTNNB1突变,β-catenin信号通路活跃,对TKI药物索拉非尼和仑伐替尼,以及ICI治疗效果差,该亚型小鼠整体生存获益差)。
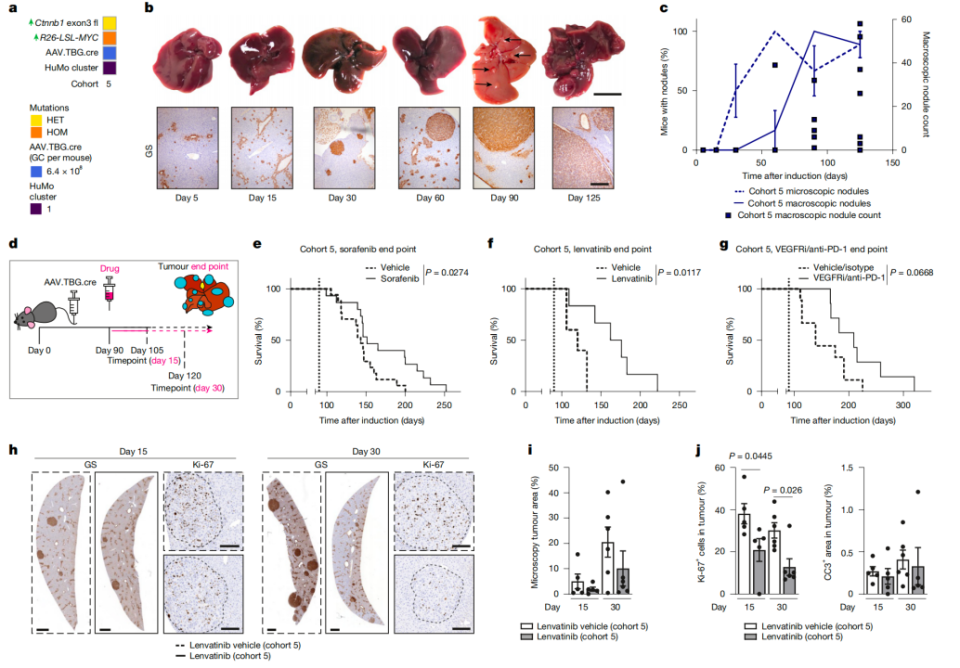
HuMo1型小鼠生存获益差
最后,研究想为这种难治的肝癌亚型寻找治疗方案,于是通过基于以上小鼠模型衍生的肝癌类器官(HCCOs)进行高通量筛选,研究人员成功从147种FDA批准的抗癌药物中,找到了一种治疗毛细胞白血病的药物,克拉屈滨。
克拉屈滨可有效干扰DNA合成,在HuMo1型小鼠模型中表现出了强效的抗肿瘤作用。在治疗方面,研究人员发现,无论是克拉屈滨单药治疗还是与仑伐替尼联合治疗,均可以显著提高HuMo1型小鼠的生存期,其中联合治疗效果更好,肿瘤几乎被完全消除。
此外,研究人员还观察到,联合治疗不仅抑制了肿瘤增殖,还提高了肿瘤中CD3阳性T细胞的浸润。而进一步,研究人员发现,在克拉屈滨与仑伐替尼联合治疗的基础上再进行ICI治疗,还能够进一步增强抗肿瘤免疫反应。
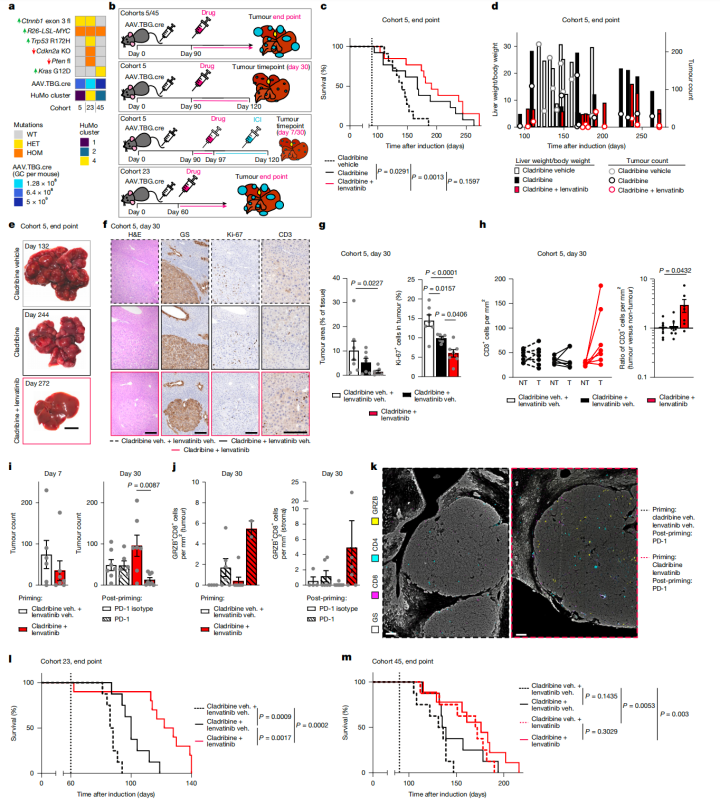
克拉屈滨治疗效果
最后,研究还测试了克拉屈滨对其他集中肝癌亚型小鼠的治疗效果,结果发现,克拉屈滨单药或联合仑伐替尼能有效延长HuMo4型小鼠的生存期,但对HuMo2型(Kras突变)小鼠无效。
综上a股加杠杆,该研究通过建立具有临床相关性的免疫功能肝癌小鼠模型,成功模拟了人类肝癌的不同亚型和分子特征,并成功找到一个针对特定肝癌亚型的抗肿瘤治疗药物。这一结果不仅为晚期肝癌治疗提供了一个新的方向,也为肝癌的个性化治疗和药物筛选提供了理论基础。
